Copyright ? 2025 廣州達博生物制品有限公司
近日,由廣州達博生物制品有限公司自主研發的基因治療藥物E10A聯用PD-1單抗方案獲得國家藥監局批準進入II期臨床試驗(批件號:2023LPO0603)。

廣州達博生物制品有限公司于近日取得國家藥品監督管理局藥品審評中心(CDE)簽發的關于E10A聯用PD-1單抗的II期臨床試驗申請受理通知書,受理號為CXSL2300046.
國家Ⅰ類新藥E10B(重組人γ-干擾素腺病毒注射液)是廣州達博生物制品有限公司(以下簡稱“公司”)自主研發的抗腫瘤基因藥物。E10B以改良后的5型腺病毒作為載體,將人γ-干擾素基因定向運載至腫瘤細胞,
由黃文林教授領銜的廣州達博生物制品有限公司研發的國家I類新藥——自體自然殺傷細胞注射液(E10H)于2022年11月28日順利完成I期臨床試驗首例受試者入組。
10月11日,廣州達博生物制品有限公司自主研發的治療用生物制品1類新藥“評估E10H在晚期消化道癌患者中安全性與耐受性的I期臨床研究”項目啟動會以線上形式圓滿開展。

5月11日,廣州達博生物制品有限公司開發的治療用生物制品1類新藥——E10B項目Ⅰ期臨床試驗啟動會以線上形式在廣州、蚌埠兩地同時舉行。
近日,由廣州達博生物制品有限公司自主研發的細胞免疫治療創新藥物E10H:自體自然殺傷細胞注射液(Autologous Natural Killer Cell Injection)獲得國家藥監局批準進入臨床試驗(批件號:2022LP00160)。
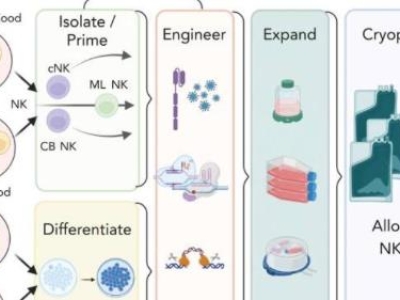
2021年11月23日,E10H申請境內生產藥品注冊臨床試驗獲得國家藥品監督管理局受理。本品屬于全新治療用生物制品,按照注冊分類1類申報1期臨床試驗。
隨著生物醫藥行業的快速發展,越來越多的生物制品開始服務于人類健康,同時各國對生物制品的質量監管也越來越嚴格,其中宿主核酸的殘留就是監管的重要一項。殘留的宿主核酸可能帶來傳染性或者致瘤風險,因此WHO及